Hoe de gezondheidsrisico’s van de NuvaRing uit de grafieken verdwenen

De Nederlandse farmaceut Organon liet cruciale gegevens die wezen op verhoogde gezondheidsrisico’s van het anticonceptiemiddel NuvaRing in zijn onderzoeken achterwege. Ook deed het bedrijf er alles aan om risico’s op trombose af te zwakken in de bijsluiter. Dat blijkt uit Amerikaanse rechtsstukken. Een reconstructie.
Het is het najaar van 2000. De Amerikaanse Food & Drug Administration (FDA) staat voor de taak een nieuw anticonceptiemiddel van Nederlandse makelij te beoordelen. De FDA moet bepalen of het de NuvaRing, het revolutionaire anticonceptiemiddel van medicijnfabrikant Organon uit het Brabantse Oss, zal toelaten op de Amerikaanse markt.
De NuvaRing is een kunststof ring die in tegenstelling tot pillen, vaginaal wordt ingebracht en drie weken lang ‘een lage’ dosering hormonen ‘stabiel’ afgeeft. Gemakkelijker dan een dagelijks in te nemen tablet, minstens even effectief in het voorkomen van zwangerschap, en door een vrouw zelf in te brengen. En het belangrijkste voordeel: de lage hoeveelheid hormonen, die bijwerkingen tot een minimum zouden beperken.
Maar bij de grootste geneesmiddelenautoriteit ter wereld zijn juist serieuze twijfels gerezen over de mogelijke bijwerkingen van de NuvaRing. Een van de medisch onderzoekers van de FDA, Daniel Davis, schat in dat het aantal trombosegevallen in de paar kleinschalige medicijnproeven al tweemaal zo hoog ligt als bekend is van pillen met dezelfde hormonen die al op de markt zijn. In vergelijking met de anticonceptiepillen die op dat moment als het veiligst worden beschouwd, is die kans zelfs bijna viermaal hoger.
‘Het is duidelijk,’ schrijft Davis in een interne evaluatie, ‘dat we bij het goedkeuren van dit nieuwe product moeten wijzen op de hogere risico’s waarmee deze hormonen in de wetenschappelijke literatuur worden geassocieerd.’
Uit documenten in handen van De Correspondent, blijkt dat er op de achtergrond een stevige onderhandeling plaats heeft gevonden tussen de FDA en Organon, dat er cruciale gegevens geassocieerd met verhoogde risico’s van het product uit onderzoeksresultaten zijn weggelaten en dat het bedrijf succesvol lobbyde om de bezwaren van de FDA uit de bijsluiter te houden.
Want als er in de bijsluiter nadrukkelijk gewaarschuwd wordt voor een hoger risico op trombose, was de NuvaRing al voor marktbetreding ten dode opgeschreven. De twijfels van de FDA leiden bij Organon dan ook tot grote onrust: het bedrijf uit Oss heeft dan al tien jaar geïnvesteerd in het anticonceptiemiddel dat juist veiliger en gemakkelijker moet zijn dan de pillen waarmee de FDA de ring vergelijkt. De farmaceut is er alles aan gelegen een gunstige gebruiksaanwijzing te krijgen en houdt zijn poot stijf in de langdurige onderhandelingen over de tekst in de bijsluiter.
Het voordeel van de twijfel
De FDA besluit, na maanden steggelen, enkele jonge tromboseslachtoffers in de medicijnproeven door de vingers te zien. In plaats van een vermelding van de twijfels van de FDA over de hormonen, wordt er in de uiteindelijke bijsluiter opgetekend dat het onbekend is of de hogere trombosekans bij pillen met dezelfde hormonen ook geldt voor de NuvaRing.
De anticonceptiering wordt tegenwoordig jaarlijks door zo’n 1,5 miljoen vrouwen gebruikt
Nederlandse en Amerikaanse medewerkers van de ‘Regulatory Affairs’-divisie van Organon zijn tevreden als de zwaarbevochten handelsvergunning uit het vuur gesleept is, zo blijkt uit de documenten. De anticonceptiering, de eerste in zijn soort, is klaar om de wereld te veroveren.
En een verovering werd het. De anticonceptiering wordt tegenwoordig jaarlijks door zo’n 1,5 miljoen vrouwen gebruikt en leverde MSD, de huidige fabrikant van de NuvaRing, in 2013 686 miljoen dollar op. Volgens MSD zijn er de eerste tien jaar 170 miljoen exemplaren verkocht en wordt het middel inmiddels in vijftig landen aangeboden. In Nederland wordt de ring jaarlijks 170 duizend keer verstrekt.
Lobbyen om informatie binnenskamers te houden
Maar dit commerciële succes heeft ook een andere kant. Afgelopen juni heeft de fabrikant een rechtszaak voor het Amerikaanse Hooggerechtshof afgerond, waar het door duizenden gebruiksters en nabestaanden werd aangeklaagd wegens het stelselmatig achterhouden van informatie. Informatie die op gezondheidsrisico’s als trombose, embolie en herseninfarcten zou wijzen.
Het resultaat van de aanklacht is een schikkingsregeling van 100 miljoen dollar, die werd geaccepteerd door 95 procent van de ongeveer 3.800 klagers. Daartegenover stond dat MSD niet schuldig werd bevonden aan het achterhouden van informatie die gebruikers en voorschrijvers van de ring wees op een hoger risico op trombose en embolie dan andere anticonceptiemiddelen.
Na een stevige publicatie in de Volkskrant november vorig jaar over die rechtszaak, ontstond in Nederland kortstondig discussie over de NuvaRing. Het Volkskrant-artikel ging in op het dubbel zo hoge risico op bloedklonters van de NuvaRing in vergelijking tot oudere anticonceptiva. Zo zou de ring net zo risicovol zijn als de Diane-35-pil, het anticonceptiemiddel dat begin 2013 in Frankrijk tijdelijk van de markt werd gehaald omdat vier jonge vrouwen er mogelijk door overleden waren. Ook in Nederland zouden er sterfgevallen zijn gerelateerd aan de Diane-35-pil.
MSD liet in een persbericht weten het artikel ‘ter kennisgeving aan te nemen’ en ‘volledig achter de NuvaRing te blijven staan.’ Henk Jan Out, voormalig vicepresident Women’s Health van het bedrijf, sneerde in een column op Artsennet.nl dat de Volkskrant met de publicatie ‘een spreekbuis’ was van Amerikaanse letselschade-advocaten.
Caroline Doornebos, medisch directeur bij MSD, reageerde in uitzendingen van de NOS en Omroep Brabant en verzekerde dat ‘er geen verschil is in trombose-risico bij de NuvaRing in vergelijking met andere anticonceptiva.’
Uit de processtukken van de Amerikaanse rechtszaak, getuigenverklaringen en correspondentie met juristen en wetenschappers doemt echter een ander beeld op. MSD heeft geprobeerd deze rechtsstukken niet toegankelijk te maken voor het publiek; maar de rechter besliste anders.
Het Nederlandse bedrijf Organon ontving voor, tijdens en na marktbetreding verschillende signalen dat de NuvaRing wel degelijk een hoger risico op bloedproppen geeft dan andere anticonceptiemiddelen, maar ondernam niets om dat wereldkundig te maken. Sterker nog, Nederlandse werknemers lobbyden effectief om deze informatie binnenskamers te houden.
De markt op
Voordat de NuvaRing zowel in Nederland als in de VS in 2001 op de markt werd toegelaten, was er in de medische wereld al veel discussie over de hormonen die gebruikt zouden worden: ethinylestradiol, een oestrogeen, en etonogestrel, een zogenoemd derdegeneratie-progestageen.
Al in de jaren negentig waren veel wetenschappers het erover eens: anticonceptiemiddelen met derde- en vierdegeneratie-progestagenen hebben een twee keer zo hoge kans op levensgevaarlijke bijwerkingen als trombose in vergelijking met middelen met tweedegeneratie-progestagenen. Van de zestien onderzoeken die dit toetsten, bevestigden dertien dit verband. Drie door de farmaceutische industrie gesponsorde studies vonden geen verband.
Dat de fabrikant ervoor koos het gepatenteerde progestageen etonogestrel wel in de NuvaRing te gebruiken, is vanuit bedrijfsmatig oogpunt logisch: het hormoon is de chemisch afgeleide van zijn voorganger desogestrel, waar in 1995 het patent op verlopen was. Toch werd etonogestrel door de geneesmiddelenautoriteiten aangemerkt als een ‘new molecular entity.’
Organon hoefde voor de erkenning van het hormoon daardoor nauwelijks nieuw toxicologisch (proefdier- en reageerbuisonderzoek) aan te leveren. Ook in de klinische fase van het onderzoek werd het bedrijf toegestaan te refereren aan trials voor oudere middelen in de portefeuille van Organon zoals Marvelon en Mercilon.
Kortom, Organon mocht op een aantrekkelijke manier een (eigenlijk niet zo) nieuw molecuul patenteren voor zijn unieke anticonceptiemiddel.
Zestien vrouwen
Om de geneesmiddelenautoriteiten te overtuigen van de effectiviteit en de veiligheid van het product, werden negen proeven gedaan door Organon.
Aan deze onderzoeken, waarvan de meeste in Nederland werden uitgevoerd, werkten 2.586 vrouwen mee. Het merendeel van de studies onderzocht de effectiviteit van de ring. Eén studie was gewijd aan de manier waarop de hormonen van de NuvaRing geabsorbeerd worden door het lichaam. Een essentiële studie, want te hoge hormoonspiegels worden geassocieerd met een grotere kans op bijwerkingen.
De studie, die het bestaansrecht van het anticonceptiemiddel moest onderschrijven, bestond uit zestien proefpersonen en werd uitgevoerd door twee Nederlandse onderzoekers van Organon.
In de grafieken en tabellen van het onderzoek, waarvan enkele uiteindelijk ook in de Amerikaanse bijsluiter en het openbare evaluatierapport van het Nederlandse College ter Beoordeling van Geneesmiddelen (CBG) opgenomen zijn, is te zien dat de gemiddelde afgifte van beide hormonen bij de gebruiksters stabiel verloopt. Goed nieuws voor Organon.
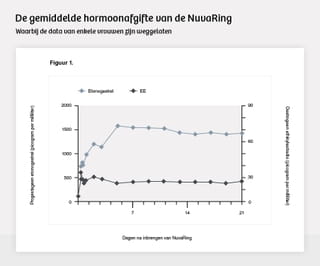
Maar de visualisaties zijn geen volledig representatie van wat daadwerkelijk bij de gebruiksters is aangetroffen.
Uit twee onderzoeksrapporten die tijdens de afgelopen juni geschikte rechtszaak zijn opgevoerd, blijkt dat data van ten minste vier vrouwen uit de grafieken en tabellen zijn gelaten. In die rapporten staat dat twee medische medewerkers van Organon dit tijdens verhoren hebben bevestigd. De Amerikaanse bijsluiter, de publicatie van het onderzoek, het evaluatierapport van het CBG en het samenvattende document dat Organon bij de FDA indiende om een vergunning te krijgen schetsen dus geen volledig beeld van de onderzoeksresultaten.
Bij vier van de zestien proefpersonen hadden vier forse pieken van het hormoon ethinylestradiol, zogenoemde ‘burst effects,’ plaatsgevonden. Bij twee gebruiksters zette de piek in binnen enkele uren na inbrenging van de ring, twee andere vrouwen ervoeren later een stoot ethinylestradiol.
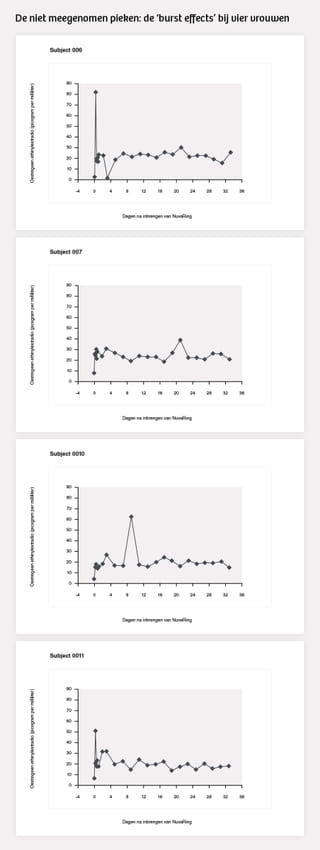
Tom Sam, destijds biochemicus bij Organon, erkende in een getuigenis in de rechtszaak dat deze uitschieters van de vier vrouwen niet in de grafieken en tabellen zijn verwerkt. Een van de onderzoekers van de trial bevestigde dat artsen die de NuvaRing aan vrouwen voorschrijven zo nooit konden weten dat enkele burst effects hadden plaatsgevonden.
In het onderzoek(je) dat dus moest aantonen dat de NuvaRing op een gelijkmatige manier hormonen afgeeft, stonden gegevens waaruit het tegendeel bleek. In september 2001, toen de FDA de aanvraag voor de NuvaRing nog in behandeling had, stuurde een bezorgde medewerker van Organon een e-mail naar een collega. Het zou zeer schadelijk zijn voor de NuvaRing als de FDA op de hoogte werd gesteld van de ‘burst effects.’ Hij schreef: ‘Going to FDA to change these specifications is absolutely the LAST thing we should consider, i.e., that’s the worse possible scenario.’
Gemanipuleerd onderzoek
Op de vraag van De Correspondent aan het de Nederlandse geneesmiddelenautoriteit CBG of het op de hoogte was van het selectieve datagebruik van de fabrikant in dit specifieke onderzoek, antwoordde het zich ‘niet voor te kunnen stellen dat de data uit de grafieken zijn gelaten.’ De autoriteit laat weten de zaak nu tot de bodem uit te gaan zoeken.
Het CBG benadrukt wel dat het vermeende klinische voordeel van de anticonceptiering niet in de Nederlandse bijsluiter wordt genoemd. ‘Wij hebben vanaf begin af aan gewezen op een verhoogd tromboserisico, vergelijkbaar met Marvelon. Wij hebben nadrukkelijk niet toegestaan dat Organon als claim in de bijsluiter mocht zetten dat de hormoonwaarden beter of geleidelijker waren dan de dagelijkse pieken die je bij een pil zou zien.’

Het samenvattend document van het CBG uit 2001 onderschrijft die stellingname. Daar valt onder meer te lezen dat de ring effectief zwangerschappen voorkomt, maar dat minder bijwerkingen ten opzichte van pillen onvoldoende zijn aangetoond: ‘Additionally, any clinical advantage of an absence of daily peak concentrations of estrogens and progestogens, in terms of a more favourable adverse event pattern, remains to be established.’
Met andere woorden: het gemanipuleerde onderzoek van Organon is ook door de Nederlandse autoriteit als leidraad genomen, maar werd te mager bevonden om de conclusies ervan te onderschrijven.
Fabrikant MSD neemt tot op de dag van vandaag het standpunt in dat de ring minder bijwerkingen heeft door een lage en constante hormoonafgifte. Zo stelt het bedrijf in een reactie op het artikel in de Volkskrant van november 2013: ‘De hormonen die de zwangerschap moeten voorkomen worden gedurende een maand gelijkmatig afgegeven. Gelijkmatige afgifte houdt in dat er in de bloedspiegels geen hormoonpieken of -dalen in het bloed optreden. Aangezien te hoge spiegels kunnen leiden tot bijwerkingen en te lage tot onvoldoende effectiviteit, is het streven naar gelijkmatige bloedspiegels een alleszins geaccepteerd en logisch uitgangspunt.’
Ter illustratie: op de MSD-website Anticonceptie.nl valt onder het kopje ‘anticonceptiering’ bij ‘Voordelen’ te lezen: ‘Een gelijkmatige hormoonafgifte: de anticonceptiering heeft daarom geen dagelijkse hormoonpieken zoals bij de pil wel het geval is.’
Trombosegevallen uit de bijsluiter
Ook deed Organon er bij de registratieprocedure in de VS alles aan om onwelwillige informatie uit de bijsluiter te halen.
In de klinische studies voor de marktbetreding, werden drie jonge vrouwen kort na het toedienen van de NuvaRing gediagnosticeerd met varianten van trombose. De FDA concludeerde op basis daarvan dat het tromboserisico van de NuvaRing twee keer hoger was dan van anticonceptiepillen met Desogestrel (waarvan bekend was dat ze een dubbel zo hoog risico op trombose geven dan tweedegeneratie-pillen).
We should really try to get it out of the text
Susan Allen, de eindverantwoordelijke van de afdeling van de FDA die de studies beoordeelde, verwees in een memo specifiek naar een van deze trombosegevallen. Een 26-jarige vrouw in een klinische studie kreeg een diepe veneuze trombose in haar linkerbeen na acht dagen de NuvaRing gedragen te hebben.
Het was voor Allen reden de fabrikant te gebieden om in de bijsluiter nadrukkelijk te wijzen op het verhoogde tromboserisico van derde- en vierdegeneratie-progestagenen, zoals die in de NuvaRing. En belangrijker, het 26-jarige trombosegeval specifiek te noemen. Zo konden artsen zelf beslissen of ze een nauwelijks onderzocht middel wilden voorschrijven dat in zo’n kleine onderzoekspopulatie al met heftige bijwerkingen was geassocieerd.
Uit interne correspondentie tussen werknemers van de afdelingen marketing en registratieprocedures in de VS en Nederland, blijkt dat dit voorstel van de FDA niet in goede aarde viel. Wim Mens, destijds werkzaam op de afdeling Regulatory Affairs in Oss, meldde zijn collega’s dat hij zich grote zorgen maakte over het noemen van dit trombosegeval in de bijsluiter. ‘We should really try to get it out of the text,’ schreef hij.
Een marketingcollega in de VS, David Stern, was het daarmee eens. Daarnaast suggereerde hij data van dieren (afkomstig uit eerder toxicologisch onderzoek) te gebruiken als ‘onderhandelingstroef’ om de FDA zover te krijgen om ‘belangrijkere zaken,’ zoals het specifieke trombosegeval, uit de bijsluiter te krijgen.
‘Een goede zaak’
Wonderwel trok Organon aan het langste eind. Door de voorstellen van de geneesmiddelenautoriteit te weigeren wist het bedrijf de vooraf vastgestelde registratieprocedure te vertragen, zo blijkt uit de documenten. De 26-jarige vrouw verdween uit de bijsluiter en er werd gesteld dat ‘het onbekend is of de hogere tromboserisico’s die geassocieerd worden met derdegeneratie-anticonceptie ook gelden voor de vaginale toediening van etonogestrel.’ De bijsluiter bevatte alleen nog een algemene waarschuwing voor bloedklontering.
Voor Organons Amerikaanse marketingdirecteur David Stern was dit nog steeds niet genoeg, zo schreef hij zijn collega’s: ‘The label change looks much better, however, I am still unhappy with the VTE section [Venous Thromboembolism, veneuze trombo-embolie, LH] of the label. Obviously the case that we presented to them [FDA, LH] has made some impact, in that they added the statement about being unknown if NuvaRing has this increased risk. What are the chances that this section can be removed all together?’
De inmiddels gepensioneerde Willem de Boer, toenmalig teamleider ‘Regulatory Affairs’ in Oss, was verheugd met de uiteindelijke bijsluiter, waar de jonge vrouw met de diepe veneuze trombose uit verdwenen was: ‘I have reviewed the new proposal for the NuvaRing Package Insert made by the FDA. To my satisfaction a number of critical issues have been implemented in the current proposal of the FDA (e.g. the deletion of the single VTE case).’
Ook zijn Amerikaanse collega Nancy Alexander liet weten de verwijdering van het trombosegeval ‘een goede zaak’ te vinden.
Een extra afdeling voor de klachten
Toch zou Organon niet eeuwig kunnen voorkomen dat zijn anticonceptiering in toenemende mate met een hoger tromboserisico geassocieerd zou worden. Direct na het verkrijgen van een handelsvergunning startte het bedrijf met nieuwe studies. Tussen eind 2001 en begin 2004 werden opnieuw drie diepe veneuze tromboses geconstateerd in een klinische setting.
En ook hier werden jonge vrouwen door de bijwerking getroffen, variërend van 20 tot 28 jaar oud. In een intern rapport uit 2006, opgesteld door Nederlandse oud-werknemers, wordt op dat moment een risico op VTE berekend van 10,1 op 10.000 vrouwjaren. Vijf jaar na de marktbetreding ziet het er dan toch naar uit dat de anticonceptiering verhoogd risico op trombose heeft.
Organon start hetzelfde jaar met een ‘VTE Issue Team,’ dat zich moet buigen over de gevoelige kwestie. Binnen Organon is men bang voor ‘underreporting,’ het fenomeen dat het aantal tromboseslachtoffers vele malen hoger ligt dan men op basis van de berekeningen inschat. Ook het publiek begint zich in toenemende mate zorgen te maken over de bijwerkingen, getuige een door een Amerikaans medebestuurder genoemde ‘dramatic increase’ in vragen van patiënten over de trombosekansen van de ring.
Mensen die de bijwerkingen gemeld hebben, mogen pas teruggebeld worden door het bedrijf nadat de juridische afdeling de melding heeft doorgelicht. Van alle gemelde bijwerkingen voor het gehele geneesmiddelenassortiment van Organon, gaan er op dat moment negen van de tien over de NuvaRing, zo blijkt uit een interne mail. Er moet bij gebrek aan capaciteit een extern bedrijf worden ingehuurd om de meldingen voor de anticonceptiering af te handelen.
Winnen van de pleister
De consternatie onder gebruikers wordt onder meer aangewakkerd door het optreden van de Amerikaanse geneesmiddelenautoriteit FDA enkele maanden eerder. Een directe concurrent van de NuvaRing, de Evra-anticonceptiepleister van fabrikant Johnson & Johnson die in Amerika een maand later dan de NuvaRing goedgekeurd werd, krijgt eind 2005 een herziene bijsluiter en een beruchte ‘black label boxwarning.’ De pleister, die zijn hormonen net als de ring op een alternatieve manier afgeeft, stelt vrouwen volgens de FDA bloot aan relatief hoge doseringen oestrogeen en heeft daardoor een ongeveer dubbel zo hoge kans op gevaarlijke bijwerkingen als tromboses.
De ‘black label warning’ heeft desastreuze effecten op de verkoop van de pleister in Amerika. Waar het bedrijf in 2005 nog zo’n 5 miljoen pleisters verkoopt, zijn dat dat er in 2011 nog geen 1,5 miljoen. De verkopen van de NuvaRing schieten in 2005 omhoog met zo’n 50 procent, naar 2,5 miljoen per jaar.
Organon krijgt de kans zijn anticonceptiering ten koste van zijn belangrijkste concurrent aan de man te brengen, maar kampt intern met de vraag hoe het om moet gaan met het risico op trombose. Immers, de pleister propageerde evengoed voor stabiele hormoonwaarden te zorgen, maar kreeg toch een nadrukkelijke waarschuwing.
Handig voor de marketing
De farmaceut schakelt de hulp in van Susan Allen, de leidinggevende van de FDA die vijf jaar eerder met Organon worstelde over de trombosegevallen in de klinische studies. Onder haar leiding keurde de FDA niet alleen de NuvaRing goed, ook de Evra-pleister kreeg door haar toedoen een vergunning. Nu verdient zij haar boterham als zelfstandig consultant voor de farmaceutische industrie.
In 2006 ontmoet Allen de Nederlandse bestuurder Hans Rekers, die op dat moment vicepresident Medical Affairs is bij Organon. Ze gaan om de tafel zitten om een ‘gepaste communicatiestrategie’ te bedenken nu het bedrijf steeds meer te maken krijgt met ‘spontane meldingen van bijwerkingen als tromboses.’
Het bedrijf besluit de problemen van de concurrent aan te grijpen om een marketingcampagne te starten waarin het de ‘voordelen’ van zijn anticonceptiering ten opzichte van de verguisde pleister aankaart. Er wordt een ‘Dear Doctor’-brief gestuurd, waarin het bedrijf artsen op de hoogte stelt van de lage oestrogeenblootstelling van de ring ten opzichte van de pleister. Ook wordt er een cursus voor de artsenbezoekers ontwikkeld, die hen moet trainen om juist op de verschillen tussen de pleister en de ring te wijzen.
Over verhoogde tromboserisico’s wordt nimmer gesproken, zo blijkt uit een getuigenis van een Amerikaanse directeur Verkoop, Sue Iannone: ‘It’s not something you’re going to see in a sales aid or in a users guide, because that’s not what healthcare providers typically want to talk about with representatives. And that’s not how we promote the products [...] because they are safe if it’s approved by the FDA and there is a label.’
Vrouwen moeten een keuze kunnen maken
In een reactie van het bedrijf op vragen van De Correspondent, laat MSD weten dat er substantieel onderzoek voorhanden is dat de veiligheid van het middel waarborgt. Het bedrijft verwijst naar de aanpassingen die het wereldwijd in bijsluiters deed om de resultaten van die studies, die beide geen hoger risico op trombose vonden ten opzichte van tweedegeneratie-anticonceptiepillen, mee te nemen. Eén van die onderzoeken heeft volgens het processtuk in handen van De Correspondent echter te weinig proefpersonen om definitief uitsluitsel te geven over de veiligheid van de NuvaRing.
Een bekende Deense studie onder leiding van de Deense professorØjvind Lidegaard, met meer dan 3 miljoen proefpersonen, trof een bijna dubbel zo hoog risico op trombose aan bij gebruiksters van de NuvaRing ten opzichte van tweedegeneratie-anticonceptie. Het onderzoek wordt door MSD op methodologische gronden niet serieus genomen.
Lidegaard hekelt de opstelling van de fabrikant, die volgens hem de discussie over de veiligheid van de middelen al jaren in de kiem probeert te smoren: ‘Er is sterk wetenschappelijk bewijs dat de NuvaRing ten minste een dubbel zo hoge kans op veneuze trombose geeft in vergelijking met de pillen van de tweede generatie.’
Op de vraag of Lidegaard van mening is dat geneesmiddelenautoriteiten moeten waarschuwen voor de risico’s antwoordt de professor bevestigend. ‘Zolang vrouwen niet worden gewezen op de verschillen in tromboserisico’s die tussen de middelen bestaan, zijn ze niet in staat een afgewogen keuze te maken.’
Ironisch genoeg acht ook de fabrikant zelf goede voorlichting van de vrouw fundamenteel. Alleen vermeldt de bijsluiter van de NuvaRing tot op de dag van vandaag geen enkele studie die de vrouw op de verhoogde risico’s ten opzichte van tweedegeneratiepillen wijst.

