Wat zijn biosimilars?
Met biologische geneesmiddelen zijn het afgelopen decennium grote stappen gezet in de gezondheidszorg. Inmiddels lopen de doorgaans zeer dure medicijnen op grote schaal uit patent, waardoor veel goedkopere vervangers, biosimilars, de markt op kunnen. De grote broer van het klassieke generieke geneesmiddel heeft een solide ontwikkelmodel, maar zijn succes staat nog niet in steen gebeiteld.
Wat zijn generieke medicijnen ook alweer?
Om te begrijpen wat een biosimilar is, moet ik eerst uitleggen wat een generiek medicijn is. Dat heeft dezelfde werkzame stof als een uit patent gelopen merkmedicijn, maar is veel goedkoper. Producenten van merkmedicijnen krijgen namelijk een bepaalde tijd een monopolie om de investeringen die nodig geweest zijn het middel te ontwikkelen, terug te verdienen. Zodra die periode afloopt, mogen ook andere producenten de werkzame stof maken. Omdat zij het stofje niet meer hoeven te ontdekken, kunnen ze tegen veel lagere kosten produceren. Medicijnen kunnen door marktdynamiek zodoende tot wel 90 procent goedkoper worden.
En biosimilars dan? Die werken volgens een vergelijkbaar principe, maar zijn niet hetzelfde als generieke medicijnen. Die hebben een (veel) eenvoudiger chemische structuur terwijl biosimilars via een biologisch proces worden gekweekt en veel ingewikkelder in elkaar zitten.
Ter illustratie: Aspirine, een bekend synthetisch medicijn, bevat 21 atomen. Enbrel, een biologisch middel tegen onder andere reuma en psoriasis (waarvan nu enkele biosimilars in ontwikkeling zijn), bevat ongeveer 20.000 atomen.
Waar is de biosimilar dan precies gelijkwaardig aan?
Biosimilars zijn de gelijkwaardige kopieën van eerder geregistreerde biologische merkgeneesmiddelen, de zogeheten ‘referentieproducten’ of ‘originators.’ Ze zijn niet identiek, maar ze zijn bij patiënten bewezen effectief en veilig.
Hoe dat kan? Een biologisch geneesmiddel bevat een werkzame stof die gemaakt wordt met behulp van levende cellen. Het gaat dan meestal om menselijke of dierlijke eiwitten die gekweekt worden in een levend organisme en daarna worden gezuiverd.
Elke biosimilar is een biological en elke biological is een niet-exacte kopie van een eerdere versie van zichzelf
Inherent aan het productieproces van biologische (en dus complexe) geneesmiddelen is dat er per productiegang heel kleine verschillen in het uiteindelijk geneesmiddel zullen optreden. Bij de registratieautoriteiten moet aangetoond worden dat die kleine verschillen niet leiden tot verschillen in kwaliteit, effectiviteit en veiligheid.
Alle volgende productieruns zullen dus een klein beetje van elkaar verschillen omdat het product gekweekt wordt in levend materiaal. Bovendien besluiten fabrikanten vaak om tijdens de patentperiode het productieproces te wijzigen, wat tevens tot minimale verschillen leidt. Enbrel , een biologisch middel van producenten Amgen en Pfizer dat al sinds 1998 wordt verkocht, heeft sinds marktintroductie al meer dan veertig productieaanpassingen gekend.
Een biosimilar is dus een nieuwe versie van een biologisch product dat al op de markt is, alleen wordt deze door een ander bedrijf vervaardigd. Met de term ‘referentieproduct’ of ‘originator’ wordt in de praktijk het biologisch product bedoeld dat de eerste fabrikant op de markt heeft gebracht.
Samenvattend: elke biosimilar is een biological en elke biological is een niet-exacte kopie van een eerdere versie van zichzelf.
Hoe worden biosimilars ontwikkeld en goedgekeurd?
Biosimilars komen op een andere manier op de markt dan referentieproducten. De registratieprocedure is niettemin uitgebreider dan die van traditionele generieke medicijnen.
Specialisten merken graag op dat bij de biosimilar een zogenoemd ‘omgekeerd ontwikkelmodel’ wordt gehanteerd; bij innovatieve middelen moet vooral patiëntenonderzoek de effecten van het nieuwe medicijn meten, bij biosimilars zit de belangrijkste inspanning vooral in het namaken van een al bestaand molecuul en bewijzen dat deze vergelijkbaar is met het origineel.
Dat betekent dat de ontwikkeling van een biosimilar een stuk goedkoper is, omdat er relatief weinig zeer duur grootschalig patiëntenonderzoek hoeft te worden uitgevoerd. Immers, hoe nauwkeuriger je in het laboratiorium kunt aantonen dat je een vergelijkbaar molecuul hebt gebouwd als een ander waar al jaren van bekend is wat de effecten op grootschalige patiëntpopulaties zijn, des te minder patiëntenonderzoek nog uitgevoerd dient te worden.
Vergelijk het met de bouw van de perfecte racewagen en het nabouwen ervan. De producent van het origineel zal zich tijdens de ontwikkeling vooral druk maken om indrukwekkende resultaten te halen op het gebied van acceleratie, topsnelheid, wegligging en veiligheid. De producent die het racemonster na wil maken zal vooral proberen de blauwdruk van het origineel in handen te krijgen om zo dezelfde motor, veren, frame en even harde banden te monteren.
Goed, wat leveren biosimilars op?
Biosimilars zijn in Europa sinds 2006 op de markt en hebben, afhankelijk van naar welke biosimilar je kijkt, besparingen opgeleverd van 20 procent – 40 procent. In Amerika komen pas sinds dit jaar biosimilars op de markt.
Zijn er obstakels die het succes van de biosimilar in de weg staan?
Ja, een behoorlijk aantal zelfs.
Een heikel punt is de voorlichting van medisch specialisten over het relatief nieuwe ontwikkelmodel van biosimilars. Medisch specialisten zijn gewend dat een product per indicatie bewezen effectief en veilig is op basis van meerdere grote patiëntstudies. Dat is bij een biosimilar niet het geval. Het patiëntenonderzoek is kleinschaliger en er is sprake van ‘indicatie-extrapolatie.’ Dat betekent: als het middel werkt bij een kritische, gevoelige indicatie, dat het dan ook bij de andere indicaties van de originator zal werken. Zijn er twijfels? Dan moet er aanvullend onderzoek worden gedaan.
Daarom vinden veel voorschrijvers nu nog dat de onderbouwing van werkzaamheid en veiligheid van biosimilars maar mager is. Toch zijn het deze specialisten die de biosimilar moeten voorschrijven, ook al profiteren ze nog niet direct van het gebruik. Het financiële voordeel gaat in Nederland hoofdzakelijk naar het ziekenhuis en uiteindelijk de zorgverzekeraars.
Specialisten willen niet door de zorgverzekeraar gedwongen worden in hun voorschrijfbeleid. En dat is bij biosimilars een probleem
Voorschrijvers zullen dus financiële overwegingen toe moeten laten in de spreekkamer, iets wat voor sommige artsen onbespreekbaar is.
Een tweede obstakel is dat er regelmatig een financiële of vertrouwensrelatie is met de merkfirma’s, die vaak meebetalen aan medisch onderzoek. Patiënten overzetten op de goedkopere biosimilar kan dus consequenties hebben voor toekomstige onderzoeksfinanciering of nevenfuncties van artsen.
Een volgend obstakel: specialisten willen en mogen niet door de zorgverzekeraar gedwongen worden in hun voorschrijfbeleid. En dat is bij biosimilars een probleem, want de afgelopen tien jaar hebben geleerd dat als niemand het gebruik van de middelen afdwingt, er niet zoveel gebeurt.
In het verlengde daarvan ligt het belangrijkste euvel, namelijk de strategische inzet waarmee belanghebbenden informatie verstrekken over biosimilars. Dat geldt zowel voor firma’s die geen belang hebben bij nieuwe marktbetreders als de partijen die niet kunnen wachten met het inboeken van forse besparingen op de geneesmiddelenrekening. Het is daardoor voor bijvoorbeeld patiëntverenigingen vrijwel onmogelijk informatie te verzamelen die niet per definitie ‘verdacht’ is, waardoor het volstrekt begrijpelijk is dat patiëntenclubs in de regel voorstaan: ‘bij twijfel: niet doen.’
Kun je patiënten die het merkgeneesmiddel gebruiken overzetten op een biosimilar?
Het College ter Beoordeling van Geneesmiddelen (CBG) heeft aan het begin van dit jaar bepaald dat dit, weliswaar onder voorwaarden, kan. Lang was de registratieautoriteit conservatief in zijn standpunt over overzetten, ook wel switchen genoemd. Toen werd aangeraden dat biosimilars alleen moeten worden ingezet bij nieuwe patiënten.
Maar ‘op basis van zorgvuldige bestudering van de recentste literatuur en ervaringen’ is dat strikte voorbehoud niet meer nodig, denkt de toezichthouder. Bestaande patiënten kunnen zonder veel problemen naar een biosimilar worden overgezet, mits dat door de arts in kwestie duidelijk wordt uitgelegd en geïnitieerd. Afgeraden wordt dat een zorgverzekeraar op eigen houtje biosimilars gaat inkopen of dat apothekers ze gaan afleveren, zonder te overleggen met de arts.
Ook moet in het kader van geneesmiddelenbewaking vastgelegd worden van welke versie - batch - de biosimilar is, op dezelfde manier als dat bij het gebruik van originatorproducten wordt aangeraden.
Waarom is overzetten - switchen - belangrijk?
Het overzetten van patiënten die al onder behandeling zijn met een biological op een biosimilar raakt de bestaande omzet van een merkfabrikant, onevenredig harder dan als alleen nieuwe patiënten een biosimilar krijgen. De discussie over overzetten is dus, veel meer dan je misschien denkt, financieel van aard. Maar wordt desalniettemin nogal vaak als medisch gepresenteerd.
Een ietwat gesimplificeerd voorbeeld.
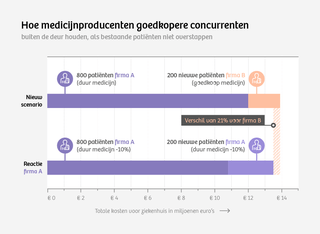
Stel dat een ziekenhuis geen bestaande patiënten wil overzetten naar een biosimilar. En dat de originator 15.000 euro per patiënt per jaar kost en de biosimilar 9.500 euro per patiënt per jaar. Ga er daarbij even van uit dat het denkbeeldige ziekenhuis 800 patiënten heeft die al behandeld worden met de bestaande medicijnen en 200 nieuwe diagnoses verwacht te stellen.
Het aandeel van bestaande patiënten is dus veel groter dan van nieuwe patiënten. Als biosimilars alleen bij nieuwe patiënten kunnen worden voorgeschreven, dan zijn fabrikanten van originators in het voordeel bij nieuwe aanbestedingen. Want: zij kunnen wel meebieden op de nieuwe patiënten, biosimilarbedrijven niet op de oude. Gevolg: de markt blijft op slot.
Om het voorbeeld door te trekken: stel dat de originatorfabrikant de biosimilar voor wil zijn en voor het nieuwe jaar een korting biedt over zowel de bestaande als de nieuwe patiënten van 10 procent. Het ziekenhuis betaalt dan 1,5 miljoen euro (1000*0.10*15.000) minder en bespaart zichzelf de moeite van een nieuw contract met een andere fabrikant voor 200 patiënten.
Een biosimilarfabrikant zal in dat scenario minimaal 1,5 miljoen euro op de geneesmiddelenrekening moeten besparen om voor het ziekenhuis aantrekkelijk te worden. Als de vraagprijs van 9500 euro per patiënt per jaar aangehouden wordt, bespaart het ziekenhuis maar 1,1 miljoen euro (200*(15.000 – 9500)) en is de biosimilarfabrikant, die al 5500 euro per patiënt per jaar goedkoper is, niet aantrekkelijk.
Dus: er moet minimaal 400.000 euro extra korting worden gegeven om een voet tussen de ziekenhuisdeuren te krijgen. En 400.000 euro is op een bedrag van (200*9500) 1,9 miljoen euro 21 procent.
Resumerend: De originatorfabrikant hoeft maar een zeer beperkte korting te bieden als hij de zekerheid heeft dat hij de medicijnen levert voor de bestaande patiënten. Daarmee prijst hij de in absolute zin veel goedkopere biosimilarproducent vrij snel uit de markt. Pas wanneer de biosimilarproducent ook op de oude patiënten kan bieden, zal een originatorproducent gedwongen worden echt te concurreren. En pas dan zullen de prijzen van de dure medicijnen fors omlaag gaan.

