Hoe de medicijnwaakhond van een half miljard mensen zijn tanden verloor
Hoe bedrijfsgevoelig is medicijnonderzoek? Deze vraag was de afgelopen jaren de inzet van een hevige strijd. Bedrijven streven naar geheimhouding, maar de Europese waakhond belooft sinds 2011 transparantie. Wat is er van deze belofte terechtgekomen? Een reconstructie.
Wie zich opgeeft als proefkonijn voor een medisch experiment, doet dat in negen van de tien gevallen met de overtuiging een maatschappelijke bijdrage te leveren.
Begrijpelijk, want je draagt een steentje bij aan een betere behandeling voor toekomstige patiënten met dezelfde aandoening.
Maar het is de vraag hoe enthousiast proefpersonen hun lichaam nog uitlenen als ze weten dat er een aannemelijke kans is dat alle opofferingen in een kluis verdwijnen, bij een farmaceutisch bedrijf of een geneesmiddelenautoriteit. Zonder dat artsen ooit iets met die informatie kunnen doen.
De ontwikkeling van een geneesmiddel betekent voor een bedrijf namelijk een investering van tientallen, zo niet honderden miljoenen euro’s in klinische proeven, met een onzekere uitkomst.
Farmaceutische bedrijven hebben er dus alle belang bij de concurrentie geen enkel kijkje in de keuken gunnen en de onderzoeksresultaten alleen met de toezichthouder te delen. Dat is dus ook al tientallen jaren de gewoonte.
Een blauwdruk voor schandalen
Maar de laatste jaren is er door medici, academici en zelfs politici in Europa een sterke lobby opgetuigd die het bedrijfsleven tot meer transparantie maant. Patiënten, de medische wetenschap en de industrie zullen juist profiteren als klinische onderzoeksgegevens toegankelijk worden voor iedereen, zo is de gedachte.
Vrijwel elk medisch schandaal is te herleiden tot het verzwijgen van bijwerkingen die al in registratieonderzoek zijn aangetroffen
Want vrijwel elk medisch schandaal is te herleiden tot het verzwijgen van bijwerkingen die al in registratieonderzoek zijn aangetroffen. Neem het overdrijven van werkzaamheid van producten, het vermarkten van pillen voor aandoeningen waarvoor geen handelsvergunning is verkregen en het afzwakken van veiligheidsrisico’s van behandelingen.
Stuk voor stuk excessen die vaak hun oorsprong vinden in het geheimhouden - of het maar ten dele publiceren - van klinisch onderzoek.
Tot een schuldbekentenis of een veroordeling komt het zelden; miljardenschikkingen halen wel elk jaar de krantenkoppen. Het gevolg? Medicatie waarvan vrijwel niemand alle informatie heeft en een sector wiens reputatie klap na klap te verwerken krijgt.
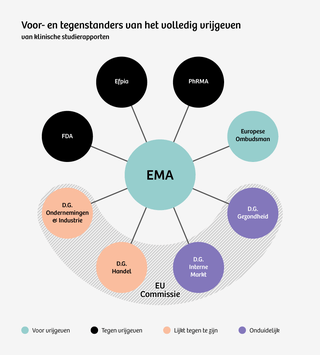
De Europese geneesmiddelenautoriteit is al enkele jaren een interessante speler in dit verhitte debat. Want zowel berucht om bizarre geheimzinnigheid, als beroemd om het dappere voornemen alles radicaal inzichtelijk te maken.
2011: Het roer moet om
Helaas is de EMA beruchter dan beroemd. De Zweedse Thomas Löngrenn, die tien jaar aan het hoofd van de organisatie stond, was tijdens zijn gehele ambtsperiode een apert tegenstander van het delen van onderzoeksgegevens.
Zijn vertrek tijdens de kerst van 2010 haalde de internationale pers. Hij zou per 2011 aan de slag gaan bij een groot consultancybureau dat farmaceutische bedrijven adviseert op het gebied van regulatory approval. Volgens velen een directe schending van de EU-richtlijnen voor belangenverstrengeling.
Na zijn tumultueuze vertrek kondigde de EMA aan eindelijk iets te doen aan de ondoorzichtige werkwijze.
De studies die bedrijven laten doen naar hun medicijnen moesten zo snel mogelijk ter inzage beschikbaar worden gemaakt voor onafhankelijke wetenschappers, zo was het voornemen van de in 2011 aangetreden directeur Guido Rasi.
‘Het proces is onomkeerbaar. De EMA is vastberaden om na het geven van een handelsvergunning op een pro-actieve manier de klinische onderzoeksgegevens te publiceren. We zijn hier niet om te beslissen of we klinische data publiceren, maar hoe we dat gaan doen,’ zo beloofde hij in 2012.
Een uniek plan. Geen enkele registratieautoriteit ter wereld had ooit dergelijke klinische data durven delen. Maar de eerlijkheid gebiedt te zeggen dat het in de jaren voor deze presentatie erg uit de hand gelopen was. Er moest iets gebeuren om de geloofwaardigheid van de EMA weer naar een levensvatbaar niveau te krijgen.
2007-2010: Geheimhouding kost levens
In The British Medical Journal, een van de gezaghebbendste medische tijdschriften ter wereld, verscheen in 2011 een verbijsterende reconstructie die de koerswijziging bij de EMA onvermijdelijk maakte.
Twee medewerkers van Cochrane beschreven hoe zij drie jaar lang met de EMA hadden geworsteld om de onderzoeksresultaten van twee omstreden anti-obesitasmiddelen in handen te krijgen.
De Cochrane-onderzoekers werkten aan een systematic review en hadden de EMA in 2007 gevraagd klinische onderzoeksrapportages en -protocollen van de middelen op te sturen. Maar de EMA weigerde dit verzoek; de dossiers zouden ‘bedrijfsgevoelige informatie’ bevatten. Tot grote onvrede van de twee wetenschappers, die naar de Europese Ombudsman stapten.
Hun klacht? De geneesmiddelenautoriteit zou patiënten onnodig in gevaar brengen, omdat voorschrijvende artsen nooit konden weten wat de voor- en nadelen van de behandelingen precies waren.
De autoriteit had patiënten onnodig in gevaar gebracht
De Ombudsman verzocht de EMA een legitieme reden te geven om de documenten geheim te houden, of anders de rapporten alsnog vrij te geven. De registratieautoriteit verzaakte op beide vlakken, waardoor de Ombudsman zich genoodzaakt voelde een kijkje te nemen in de kluis van de EMA.
Ondertussen verdween een van de anti-obesitasmiddelen, Acomplia, zomaar van de markt. De EMA concludeerde in januari 2009 dat de pil een onacceptabel risico op psychische stoornissen en zelfs zelfmoord bood.
Let wel: de pil werd door de EMA van de markt gehaald op vrijwel hetzelfde moment dat de toezichthouder de Cochrane-onderzoekers verweet onvoldoende te hebben onderbouwd dat er bij het vrijgeven van de documenten een ‘dwingend algemeen belang’ gemoeid zou zijn.
De conclusie van de Ombudsman loog er dan ook niet om: de onderzoeksdossiers en de protocollen bevatten geen enkel bedrijfsgeheim. Halverwege 2010 - de Ombudsman had eerder al een voorlopige vaststelling van wanbestuur gedaan - kon de EMA weinig anders meer dan de Cochrane-onderzoekers toegang te geven tot de dossiers. De autoriteit had patiënten onnodig in gevaar gebracht en moest diep door het stof.
Vanaf dat moment ging de EMA onder toeziend oog van de Ombudsman op verzoek documenten vrijgeven.
2013: De strijd ontbrandt
Maar de ingreep van de Ombudsman noopt het bedrijfsleven tot actie. Begin 2013 slepen twee farmaceutische multinationals, waaronder het Amerikaanse AbbVie, de EMA voor de Europese rechter.
AbbVie wil dat zijn onderzoeksrapporten van de TNF-alfa-remmer Humira niet worden geopenbaard. Dit product leverde AbbVie in 2014 meer dan 12,5 miljard dollar op, 63 procent van de totale jaarlijkse inkomsten van het bedrijf. Humira is op dit moment het best verkochte geneesmiddel ter wereld.
Met het vrijgeven van de documenten, zou volgens ‘commercieel vertrouwelijke informatie’ op straat komen te liggen. Ook is AbbVie tegen openbaring van documentatie die ‘niet op een zinvolle manier bijdraagt tot de wetenschappelijke evaluatie van onze producten,’ zo valt in een persverklaring te lezen.
Bij de EMA werken ze intussen gewoon door. In de zomer van 2013 schreef Rasi nog dat klinische onderzoeksrapporten eigenlijk nooit commercieel vertrouwelijke informatie bevatten. In het zeldzame geval dat dat wel zo is, ‘weegt het publieke belang op tegen overwegingen van commerciële vertrouwelijkheid.’
Dan komt de lobby van het bedrijfsleven pas echt op gang.
The Guardian opent in juli dat jaar met een verhaal over de Europese brancheorganisatie van geneesmiddelenfabrikanten. De krant heeft interne communicatie waaruit blijkt dat de aangesloten farmaceutische bedrijven worden aangespoord om patiëntverenigingen te ‘mobiliseren’ tegen het nieuwe transparantiebeleid van de EMA.
AbbVie wordt in de rechtszaak tegen de EMA gesteund door zowel de Amerikaanse brancheclub van farmabedrijven als de Europese lobbygemeenschap. Fabrikant Pfizer zou een juridisch adviseur hebben uitgeleend om het bedrijf in de rechtszaal te ondersteunen.
Eind 2013: Europese Hof fluit bedrijven terug
Maar aan het eind van 2013 blijkt de EMA een aanzienlijke kans te hebben om in de rechtbank aan het langste eind te trekken. Het Europese Hof van Justitie heeft in een hoger beroep van de EMA de argumentatie achter het tijdelijke publicatieverbod afgewezen, omdat er helemaal niet is aangetoond dat er bedrijfsgevoelige informatie op straat komt te liggen bij het vrijgeven van de onderzoeksdocumenten.
Alleen als de bedrijven kunnen aantonen dat het vrijgeven van documenten uit de klinische proeven hun bedrijfsvoering onherstelbare schade aanbrengt, mogen zij zich van het Europese Hof van Justitie beroepen op de tussentijdse bepaling, maar ook alleen in die specifieke gevallen, zo mailt Guido Rasi zijn collega’s in december. ‘Hoewel we de zaak nog niet hebben gewonnen, is dit de eerste belangrijke stap sinds het begin van de processen. We willen graag onze positieve gevoelens met jullie delen.’
Maar een definitieve uitspraak zal er nooit komen.
Begin 2014: Buiten de rechtszaal opgelost
Op 3 april wordt namelijk bekend dat AbbVie zijn zaak tegen de EMA laat vallen. De twee partijen hebben het conflict buiten de rechtszaal opgelost.
‘Een aanzienlijk deel van de data zal worden geopenbaard, terwijl de informatie die commercieel gevoelig is wordt beschermd,’ aldus AbbVie in een persverklaring. ‘Daarom heeft AbbVie zich teruggetrokken uit de rechtszaken.’
Volgens de EMA zou het onleesbaar maken van informatie nauwelijks van invloed zijn op de bruikbaarheid van de documenten.
Bedrijven krijgen de mogelijkheid om commercieel gevoelige informatie voor publicatie zwart te maken
Is de EMA als sterkste uit de strijd gekomen? Even lijkt het erop. Maar als in mei dat jaar de voorlopige notulen over het nieuwe transparantiebeleid in omloop komen, wordt duidelijk dat het beloofde beleid juist ingeperkt wordt.
In de nieuwe plannen mogen studierapporten alleen op een beeldscherm, via software van de EMA worden ingezien. Ze worden praktisch onbruikbaar voor onafhankelijke onderzoekers.
Nog belangrijker: bedrijven krijgen de mogelijkheid om commercieel gevoelige informatie voor publicatie zwart te maken.
Zomer 2014: Wat hebben de schikking en de draai met elkaar gemeen?
In The British Medical Journal verschijnt enkele weken na de rechtszaak een artikel van Peter Doshi, een bekende onderzoeker van Cochrane.
Hij en een Duitse collega hebben de zwart gemaakte stukken in de onderzoeksdocumenten van het product van AbbVie vergeleken met de aangepaste beleidsnota van de EMA die in zijn algemeen over de inhoud van zwart te maken informatie gaat. Zij concluderen: ze komen ‘opvallend’ overeen.
Met andere woorden: de schikking tussen AbbVie en EMA lijkt een blauwdruk geworden voor de manier waarop de EMA zijn transparantiebeleid vorm gaat geven.
Deze conclusie zal later verder worden gestaafd, als de Ombudsman documenten en presentaties van de EMA publiceert die net na de beleidswissel intern zijn verspreid. In tabellen waarin mogelijke bezwaren opgesomd worden die het zwart maken van informatie zouden kunnen rechtvaardigen, staan precies de aanpassingen die in de studierapportages van Humira zijn doorgevoerd.
En hoewel Humira niet bij naam genoemd wordt, verwijst het EMA-document wel naar een voorbeeld uit de praktijk dat duidelijk gemaakt heeft dat sommige hoofdstukken zwart gemaakt kunnen worden. ‘For example, in some trials for a new anti-inflammatory medicinal product [...],’ zo valt er te lezen. En Humira valt onder de ‘anti-inflammatory drugs.’
Daarmee is de ontmoeting met AbbVie buiten de rechtszaal dus vrijwel zeker van invloed geweest op het herziene beleidsplan van de EMA.
Welke hoofdstukken zijn zwartgemaakt?
De Europese Ombudsman stuurde in november vorig jaar vragen naar de EMA, waarin opheldering wordt gevraagd over de argumentatie achter de talloze onleesbare passages in de Humira-documenten. Sommige zwart gemaakte stukken tekst zijn acceptabel, omdat ze identificeerbare gegevens van patiënten bedekken of zakelijke relaties van AbbVie beschermen. ‘Maar bij de rest van de aanpassingen heb ik mijn twijfels en uit ik mijn zorgen,’ zo schrijft de Ombudsman.
We waren lange tijd erg optimistisch over de transparantieplannen van de EMA, maar we zijn nu erg ongerust
‘We waren lange tijd erg optimistisch over de transparantieplannen van de EMA, maar we zijn nu erg ongerust, in het bijzonder door de AbbVie-zaak,’ zo concludeerde Ben Goldacre, schrijver en activist op een meeting in het Europees Parlement. Hij heeft grote twijfels over de geheimgehouden informatie in de stukken van Humira.
Onder de onleesbaar gemaakte passages vallen volgens de Ombudsman onder andere overwegingen in het bepalen van de steekproefomvang, maar ook protocolwijzigingen die tijdens de uitvoering van de onderzoeken zijn doorgevoerd.
‘Ik kan geen enkele reden bedenken waarom protocolwijzigingen in wetenschappelijk onderzoek commercieel vertrouwelijke informatie bevatten, [...] al helemaal niet van het soort dat opweegt tegen het belang van de publieke gezondheid,’ aldus Goldacre. ‘Als iemand zijn protocol na de start van een onderzoek aanpast, heeft dat waarschijnlijk te maken met het feit dat er een onwelgevallige bevinding is gedaan’.
Juni 2013: Een opmerkelijke personeelswissel
Wat er precies bij het gesloten akkoord tussen de EMA en AbbVie gezegd is, zal altijd onduidelijk blijven. Opvallende ontwikkelingen rond de zaak zijn er wel.
Zo was er de personeelswisseling in de top van de EMA, vijf maanden nadat Abbvie en een andere fabrikant naar de rechter stapten. De Italiaan Stefano Marino werd in juni 2013 hoofd juridische zaken; zijn voorganger vertrok in 2012 naar een internationaal opererend advocatenkantoor, bij de afdeling in Brussel die farmaceutische bedrijven adviseert op het gebied van marktbetreding.
Marino heeft een ruime vijftien jaar in de industrie gewerkt. Bij de brancheorganisatie Epfia was hij acht jaar directeur Legal and Intellectual Property Affairs. Hij heeft daardoor de hoogste score voor EMA-werknemers met mogelijke belangenconflicten. Opmerkelijk genoeg staat zijn achtjarige voorzitterschap niet in zijn belangenverklaring van de EMA.
Opvallend, omdat Europese brancheorganisatie Efpia Abbvie in de rechtszaak bijsprong en achter de schermen aandrong op de mobilisatie van patiëntorganisaties die het transparantiebeleid in twijfel moesten trekken.
Desalniettemin was Marino nauw betrokken bij ‘de beoordeling van het beleidsontwerp vanuit een juridisch perspectief [...],’ zo schreef Guido Rasi in een antwoord op vragen van lobbywaakhond Corporate Europe.
En de rol van de Europese Commissie?
De Ombudsman heeft eveneens communicatie tussen de EMA en de Europese Commissie gepubliceerd. Communicatie die rond de onderhandelingen over het beleid en de diening van de rechtszaken werd gevoerd. En daaruit valt op te maken dat er zeer waarschijnlijk nog een belangrijke verklaring is voor het afgezwakte transparantievoornemen: de onderhandelingen rond het Trans-Atlantisch Vrijhandels- en Investeringsverdrag, TTIP.
Onder de zorgen die geuit zijn door de Europese directoraten-generaal valt de vraag of het nieuwe beleid ‘de harmonisering tussen de EMA en de FDA [de Amerikaanse Food and Drug Administration, LH]’ in de weg zit.
Precies die harmonisatie is een van de belangrijkste overwegingen in het handelsverdrag voor de Europese Commissie als het gaat om geneesmiddelen.
Maar daar wringt de schoen op het gebied van klinische data, want de FDA publiceert alleen samenvattingen van onderzoek, in principe geen studierapporten. Sterker, de Amerikanen zijn uitgesproken kritisch over het transparantiebeleid van de EMA, zo blijkt uit een fors rapport van de Amerikaanse Kamer van Koophandel.
Hoe groot is de lobby?
Pikant genoeg zijn er concrete aanwijzingen dat zowel de Amerikaanse brancheclub als de Europese stevig lobbyen om de EMA in het gareel te krijgen. In een brief aan het Witte Huis schrijft de Amerikaanse lobbyorganisatie in 2013 dat het voorgestelde databeleid van de EMA een van zijn belangrijkste zorgen is voor het te sluiten verdrag. ‘PhRMA en zijn leden dringen er bij de Amerikaanse overheid op aan op alle mogelijke manieren de strijd aan te gaan met de Europese Unie, om te verzekeren dat data op een verantwoordelijke manier zal worden gedeeld’.
Dat jaar lekte er ook een wensenlijst voor TTIP uit, afkomstig van beide lobbyorganisaties. Daarin wordt van de twee registratieautoriteiten verwacht dat ze ‘een op elkaar afgestemde benadering in het openbaren van klinische onderzoeksdata’ en ‘een uniforme bescherming van commerciële vertrouwelijke informatie en handelsgeheimen’ zullen hanteren.
Die opvatting lijkt ook in de Europese Commissie te zijn geland, hoewel verder onderzoek dat duidelijk moet maken. Helder is in ieder geval dat het bedrijfsleven er alles aan gelegen is om zo weinig mogelijk prijs te geven over klinisch onderzoek.
‘Ik denk dat er een grote strijd gaande is over een nieuw medisch innovatiemodel, waarin transparantie een van de belangrijkste strijdpunten is,’ zo betoogde David Hammerstein in een interview in oktober. Hij is een van de mensen die niet begrijpt waarom de EMA de zaak van AbbVie buiten de rechtszaal heeft opgelost. ‘Transparantie kan als een katalysator werken om de farmaceutische industrie weer richting de behoeften van patiënten te duwen [...]. Het zou helpen het medische debat weer wetenschappelijk te maken, in plaats van het door marketing gestuurde model dat we nu hebben. Waarin bedrijven soms meer uitgeven aan marketing dan aan onderzoek.’






